Pode haver um paradoxo na biologia do envelhecimento. À medida que os humanos envelhecem, seus metabolismos tendem a desacelerar, perdem a massa muscular e queimam muito menos calorias. Mas certas células em idosos parecem fazer exatamente o oposto – elas consomem mais energia do que quando eram jovens.
Esses porcos de energia potencial são células senescentes, células mais antigas que pararam de se dividir e não desempenham mais as funções essenciais que costumavam. Como eles parecem ociosos, os biólogos assumiram que as células senescentes do tipo zumbi usam menos energia do que seus colegas mais jovens, replicando ativamente, diz Martin Picard, psicobiologista da Universidade de Columbia, em Nova York.
Como matar as células ‘zumbi’ que fazem você envelhecer
Mas em 2022, Gabriel Sturm, ex -estudante de graduação da Picard, observou meticulosamente o curso de vida das células da pele humana cultivadas em um prato1 E, em achados que ainda não foram publicados na íntegra, descobriram que as células que pararam de dividir tinham uma taxa metabólica do dobro da das células mais jovens.
Para Picard e seus colegas, a incompatibilidade energética não era um paradoxo: as células envelhecidas acumulam formas de dano energeticamente caras, como alterações no DNA, e elas iniciam a sinalização pró-inflamatória. Como isso corresponde ao gasto de energia relativamente baixo para organismos envelhecidos ainda não está claro, mas os pesquisadores levantam a hipótese de que essa tensão pode ser um fator importante de muitos dos efeitos negativos de envelhecer e que o cérebro pode estar desempenhando um papel -chave como mediador2. À medida que algumas células envelhecem e requerem mais energia, o cérebro reage retirando recursos de outros processos biológicos, o que resulta em sinais externos de envelhecimento, como cabelos grisalhos ou uma redução na massa muscular (consulte ‘Gerenciamento de energia e envelhecimento’).
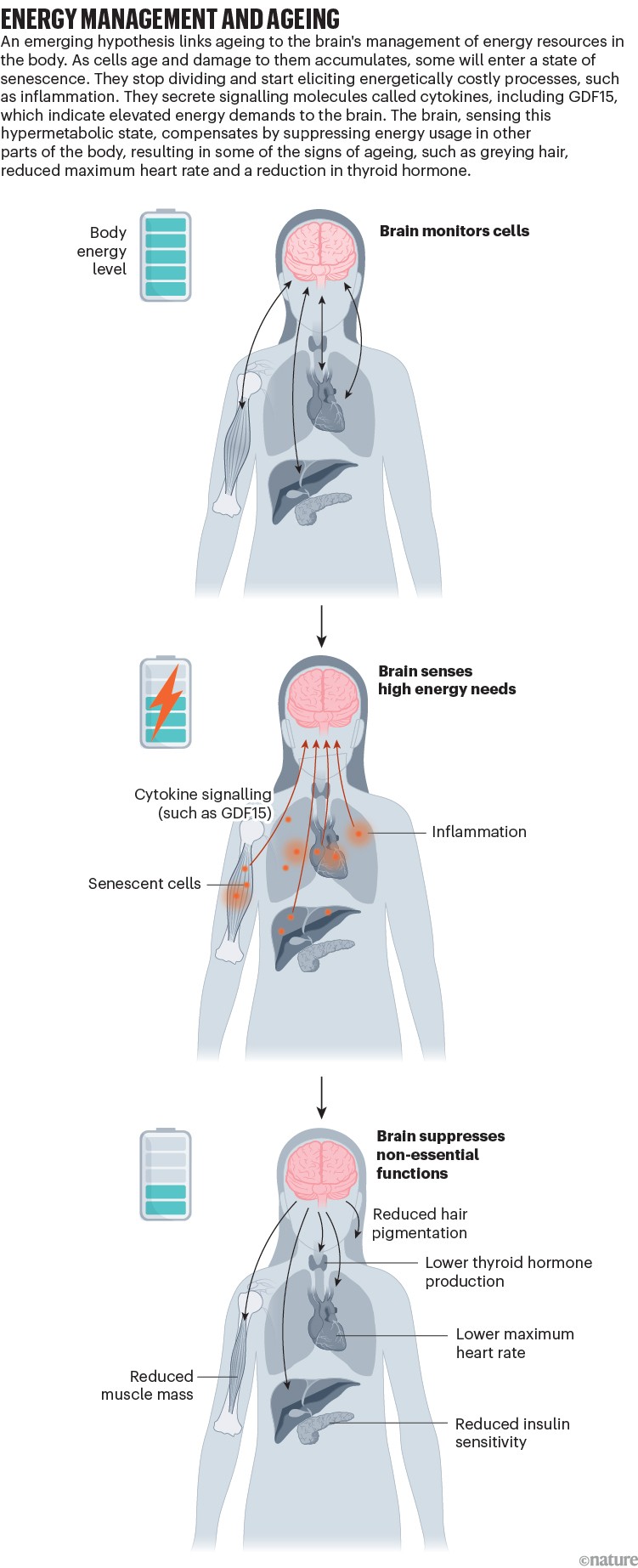
Fonte: Ref. 2
Picard e seus colegas chamam esse conceito de ‘modelo de conservação de energia do cérebro’. E embora muitas partes da hipótese ainda não sejam testadas, os cientistas estão trabalhando para decifrar os mecanismos precisos que conectam o cérebro a processos associados ao envelhecimento, como senescência, inflamação e encurtamento dos telômeros – os trechos do DNA repetitivo que capacitam as extremidades dos cromossomos e os protegem. Segundo alguns pesquisadores, esse trabalho também está começando a esclarecer como o estresse psicológico pode acelerar o envelhecimento em nível molecular. Embora uma vez às margens da pesquisa em envelhecimento, essa idéia agora está se tornando popular, diz Alessandro Bartolomucci, biólogo da Universidade de Minnesota em Minneapolis. “A ciência fala por si. O campo não pode descartá -lo.”
Desgaste
Algumas das primeiras evidências que apontam para o papel do cérebro no envelhecimento vieram de estudos que revelaram os efeitos do estresse psicológico nas células individuais.
No início dos anos 2000, Elissa Epel, que era pesquisadora de pós -doutorado na Universidade da Califórnia, São Francisco (UCSF), partiu com seus colegas para examinar se o estresse crônico poderia deixar para trás uma assinatura celular. Na época, já havia uma “literatura muito impressionante” ligando o estresse a longo prazo à problemas de saúde, diz Epel, que agora é psicólogo em saúde da UCSF. “Mas não sabíamos muito sobre o que estava acontecendo no nível celular.”
Então, os pesquisadores decidiram olhar para a duração dos telômeros. Os telômeros diminuem progressivamente ao longo da vida útil de um organismo, e esse processo tem sido associado à senescência e outras formas de alterações relacionadas à idade nas células.

Com que rapidez você está envelhecendo? O que os ‘relógios’ moleculares podem lhe dizer sobre sua saúde
A equipe recrutou um grupo de 58 mulheres saudáveis: 19 das quais tinham uma criança saudável; e 39 dos quais tiveram um filho com uma doença crônica. Os pesquisadores argumentaram que o último grupo geralmente experimentou níveis aumentados de estresse em comparação com as mulheres que tiveram filhos saudáveis3. A equipe de Epel descobriu que as mulheres com uma criança com doenças crônicas tinham telômeros mais curtos do que aqueles que não o fizeram – e esse comprimento dos telômeros se correlacionou com o número de anos gastos como cuidador. Esses achados sugeriram que a exposição ao estresse crônico pode introduzir mudanças moleculares importantes para o envelhecimento, diz o biólogo Noah Synder-Mackler na Universidade Estadual do Arizona em Tempe.
Desde então, as equipes também encontraram evidências de encurtamento de telômeros em pessoas expostas a outros estressores, como experiências adversas na infância e exaustão relacionada ao trabalho4. Embora alguns dos resultados tenham sido misturados quando se trata de comprimento dos telômeros, os pesquisadores também acumularam evidências que ligam o estresse a outros marcadores moleculares do envelhecimento.
Por exemplo, Anthony Zannas, médico -cientista da Universidade da Carolina do Norte em Chapel Hill, e seus colegas mostraram, através de estudos de grandes coortes de pessoas, que altos níveis de estresse ao longo da vida foram associados a sinais de envelhecimento acelerado no epigenoma, que os padrões de modificações químicas ao genoma, como dna. Essas mudanças podem ser mediadas por hormônios do estresse, como o cortisol. A equipe de Zannas descobriu que, nas mulheres, níveis mais altos de cortisol estavam ligados a níveis mais baixos de metilação do DNA, bem como um aumento na expressão da codificação do gene para o fator de necrose tumoral (TNF), uma molécula de sinalização associada à inflamação5.
O exercício pode ajudar a mitigar alguns dos efeitos do estresse no envelhecimento. Crédito: Kevin Frayer/Getty
Outros estudam esses processos em animais. Embora os modelos animais de estresse tenham suas limitações – por um lado, os estressores dos seres humanos são muito mais complexos e podem incluir uma variedade de fatores sociais, psicológicos e biológicos -, este trabalho forneceu informações mecanicistas difíceis de obter nos estudos em humanos. Bartolomucci e sua equipe descobriram que o estresse social crônico em roedores, como ser submetido a um comportamento agressivo de um animal dominante, pode danificar a saúde do coração e levar a uma vida útil mais curta6. Eles também descobriram que a exposição a esse tipo de adversidade está ligada a um aumento de alterações moleculares relacionadas à idade, como um acúmulo de sinais associados à senescência.
Por exemplo, em um estudo de 2024 de ratos machos, a equipe de Bartolomucci demonstrou que o estresse social durante um período relativamente breve no início da vida levou a um aumento nos níveis de um marcador importante da senescência celular, chamada P16, no cérebro, tecido adiposo e células imunológicas7. Essas mudanças ocorreram apenas em resposta ao estresse social: animais expostos ao estresse na forma de restrição física, que envolviam colocá-los em pequenos tubos por três horas por dia durante um mês, não experimentaram um acúmulo de P16.

Hackear o sistema imunológico pode diminuir o envelhecimento – eis como
A equipe de Synder-Mackler tem conduzido estudos semelhantes em macacos rhesus. Esses animais tendem a formar hierarquias dentro dos grupos, com os recém -chegados caindo para mais baixas fileiras sociais. Assim, ao introduzir sequencialmente os animais em grupos, os pesquisadores foram capazes de examinar os efeitos do status social na saúde. Eles descobriram que o estresse social afeta o sistema imunológico de várias maneiras. Nas células imunes dos macacos com menor status social, levou a um aumento na expressão de genes associados à inflamação8. Esses efeitos foram pelo menos parcialmente reversíveis: quando os rankings sociais dos animais foram reorganizados, os padrões de expressão gênica em suas células imunes também mudaram para corresponder à sua classificação. A equipe ainda não analisa como essas alterações afetam a vida útil-os macacos podem viver por cerca de 30 anos, o que dificulta a abordagem desse problema, diz Synder-Mackler.

